Peso Atómico
Es el número de electrones que tiene cierto compuesto químico.
Regla del Octeto
La regla del octeto dice que, la tendencia de los átomos de los elementos del sistema periódico, es completar sus últimos niveles de energía con una cantidad de electrones tal que adquiere una configuración semejante a la de un gas noble, ubicados al extremo derecho de la tabla periódica y son inertes, o sea que es muy difícil que reaccionen con algún otro elemento pese a que son elementos electroquímicamente estables, ya que cumplen con la ley de Lewis, ó regla del octeto. Esta regla es aplicable para la creación de enlaces entre los átomos.
Electrovalencia
Configuración Electrónica de los Elementos Químicos
En la tabla periódica siguiente se indica la configuración electrónica de los elementos químicos. Se han resaltado (en negrita) los elementos químicos que presentan configuraciones electrónicas distintas de las esperadas en función de las reglas de llenado de los orbitales. Para cada elemento se indica únicamente la configuración electrónica del último nivel.

Enlaces Químicos
Es la unión entre dos o más átomos para formar una entidad de orden superior, como una molécula o una estructura cristalina. Para formar un enlace dos reglas deben ser cumplidas regla del dueto y la regla del octeto.
Tipos de enlace
El enlace entre dos átomos nunca se corresponde exactamente con una de las siguientes categorías. Sin embargo, son útiles para clasificar muchas de las propiedades y reactividad química de una gran variedad de compuestos.
Enlace Simple | Enlace Doble o Secundario | Enlace Triple o Terciario | Enlace Cuádruple |
Los enlaces covalentes entre átomos de carbono se diferencian por su fortaleza, su longitud y su geometría.
La fortaleza de un enlace se mide por la cantidad de energía que es necesario para suministrar y romperlo.
La longitud de un enlace es la distancia que separa los dos centros de los átomos que están unidos.
La geometría es la orientación de las moléculas en el espacio.
Clases de Cadenas Carbonadas
--C=C--C=C--- |
Tipos de Enlace
a) Cadenas Carbonadas Saturadas
Son aquellas cuyos átomos de carbono están unidos por enlaces simples.
b) Cadenas Carbonadas No Saturadas
Considerando la forma de la cadena
Son aquellas cuyos átomos de carbono están unidos por enlaces terciarios.
Cadenas Abiertas o Acíclico
a) Lineal

b) Ramificada
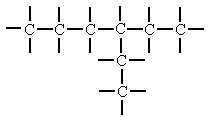
Cadenas Cerradas o Cíclica
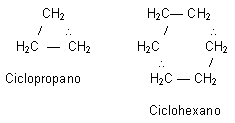
CH4 | Fórmula desarrollada o estructurada | Ubicación en el espacio de los átomos. | |
--C -- | H3C – CH3 C2H6 | Fórmula semidesarrollada o semiestructurada. | Tipos de Enlace que unen a los átomos de carbono. |
H – H2C = C – CH3 C3H6 | Fórmula Global, General o Empírica | Número de átomos de cada uno de los elementos químicos que forman la molécula |
Carbono Primario.- El máximo número de hidrógenos con que se puede combinar un carbono es de 4.
Carbono Secundario.- Son los carbonos que tienen 2 valencias saturadas por hidrogeno.
Carbono Terciario.- Son aquellos que solo tienen saturadas por hidrogeno.
Carbono Cuaternario.- Son los carbonos que forman todos sus en laces con átomos de carbono o con otros radicales no con hidrogeno.
1) Hidrocarburos
Compuestos binarios formados por Hidrógeno y Carbono.
H3C – CH3 ----> C2H6
H2C = CH2 ----> C2H4
HC == CH ----> C2H2
C – C – C – C – CH3 H3 H2 H2 H2 | C – C = C – C – CH3 H3 H H H2 | H3 C – C – C =- C – C H3 H2 |
C5H12 | C5H10 | C5H8 |
Clases de Hidrocarburos
Alcanos ( - ) CnH2n + 2 C10H22
Alquenos ( = ) CnH2n C10H20
Alquinos ( =- ) CnH2n - 2 C10H18
C7H? (3=) ---> C7H10
C7H? (3=-) ---> C7H4
# Carbonos | Prefijo | Sufijo |
1 | MET | ANO ENO INO |
2 | ET | |
3 | PROP | |
4 | BUT | |
5 | PENT | |
6 | EX | |
7 | HEPT | |
8 | OCT | |
9 | NON | |
10 | DEC |
2) Oxigenadas
3) Nitrogenadas
Grupo carbonilo
Es un grupo funcional que consiste en un átomo de carbono con un doble enlace a un átomo de oxígeno. La palabra carbonilo puede referirse también al monóxido de carbono como ligando en un complejo inorgánico u organometálico; en este caso, el carbono tiene un doble enlace con el oxígeno.
Un grupo carbonilo caracteriza los tipos siguientes de compuestos (-CO quiere decir un grupo carbonilo):
Compuesto | Estructura | Fórmula |
Aldehído | RCHO | |
Cetona | RCOR' | |
Ácido carboxílico | RCOOH | |
Éster | RCOOR' | |
Amida | RCONR'R" | |
Enona | RCOC(R')=CR"R"' | |
Cloruro de ácido | RCOCl | |
Anhídrido | (RCO)2O |
Aldehído
Son compuestos orgánicos caracterizados por poseer el grupo funcional -CHO:
Es decir, el grupo carbonilo -C = O está unido a un solo radical orgánico.
Ácido carboxílico
Los ácidos carboxílicos constituyen un grupo de compuestos que se caracterizan porque poseen un grupo funcional -COOH llamado grupo carboxilo se produce cuando se une un grupo hidroxilo (-OH) y carbonilo (C=O). Se puede representar como COOH ó CO2H.
Éster
Son compuestos orgánicos en los cuales un grupo orgánico reemplaza a un átomo de hidrógeno (o más de uno) en un ácido oxigenado.
Un ácido oxigenado es un ácido cuyas moléculas poseen un grupo OH– desde el cual el hidrógeno (H) puede disociarse como un ion protón (H+).

No hay comentarios:
Publicar un comentario